发布时间:2016-07-28 来源:本站 浏览次数:0次
某某公司主要从事戊型肝炎疫苗、人头乳头瘤病毒疫苗以及诊断试剂制造工艺与质量标准的研发和生产。
“某某公司产研基地”项目将依托厦门大学“国家传染病诊断试剂与疫苗工程技术研究中心”,以戊肝疫苗、人乳头瘤病毒疫苗诊断试剂等成果转化为契机,承担诊断试剂和疫苗产品的技术开发和成果转化工作。即以戊肝疫苗、人乳头瘤病毒疫苗诊断试剂等成果转化为契机,完成传染病诊断试剂与疫苗制造工艺与质量标准开发平台、中试平台、临床研究平台和新药注册平台等关键技术平台建设。
本项目位于海沧新阳工业区内,规划建设一条包括研发中心、cGMP厂房及配套设施、配备先进的基因工程发酵、纯化和灌装联动线等主要生产设备、年生产1000万支/年的基因工程疫苗生物制品生产线。
研发和生产过程包括原液制备(包括种子液制备、发酵、纯化和复性)、原液检定、半成品配制、半成品检定、成品分装、成品检定和成品包装等七步骤。原液制备、原液检定等生产过程中会排放一定量的废水,如废水未经处理直接外排,会对周围水域及土壤等造成污染。因此需要建造相应的工业污水处理设施。
生产工艺及质检流程说明:
(1)原始菌种:由“国家传染病诊断试剂与疫苗工程技术研究中心”(设于厦门大学)应用PCR方法获取HEV的类病毒颗粒,亚克隆入大肠杆菌表达截体,转化大肠杆菌,获得原始菌种,菌种经速冻闭封用汽车运输至基地保存至种子库待用。
(2)原液制备:原液制备包括种子液制备和种子液接种、发酵培养以及纯化复性四个环节
①种子液制备:将检定合格的原始菌种批接于适宜的培养基培养,供发酵罐接种用。
②种子液接种:在灭菌的发酵培养基中接种适量的种子液;
③发酵培养:按发酵工艺条件进行,发酵结束后用离心的方法收集菌体。
④纯化和复性:菌体经高压匀浆破裂后, 收集包涵体,用层析方法进行纯化,除菌过滤后即成原液,4℃下保存。
(3)原液检定:需进行检定项目包括无菌试验,蛋白质含量、蛋白质分子量测定、纯度、大肠杆菌菌体蛋白残留量、残留量测定等。
(4)半成品的配制:用PBS稀释原液中蛋白的浓度至适量并量取1体积, 加入9体积适当浓度的氢氧化铝佐剂、氯化钠及硫柳汞,即成半成品。
(5)半成品检定:需进行的检定项目包括菌试验、铝含量测定、硫柳汞含量、PH值、吸附完全性试验和细菌内毒素检测。
(6)半成品分装:按《中华人民共和国药典 三部》(2005年版)中的《生物制品分装规程》进行。容器为1ml注射器,每支注射器装0.5 ml,含重组戊肝病毒结构蛋白20ug。
(7)成品包装:按《中华人民共和国药典 三部》(2005年版)中的《生物制品分装规程》进行。
由病毒、细菌或其他病原微生物为起始材料,经培养增殖制成的减毒、灭活的病原体,或再经纯化、裂解等方法处理制备的富含免疫原性,刺激机体产生特异性免疫学反应而达到预防某种疾病的产品,为预防用疫苗。本项目主要从事戊型肝炎疫苗、人乳头瘤病毒疫苗诊断试剂的生产。
本项目研发中试车间及产业化疫苗生产制造流程按GMP要求分四个车间完成(发酵车间、纯化车间、制剂车间和包装车间),两种疫苗制造流程在相应生产车间内分区生产,由于两种疫苗生产流程及产污环节基本相同,各区排放的污染物统一收集按相关要求处理进行,原液检定和半成品检定产生的质检废水经灭菌消毒处理后排入污水处理设施处理。制造流程分述如下:
(1)戊型肝炎疫苗制造流程及产污环节说明:
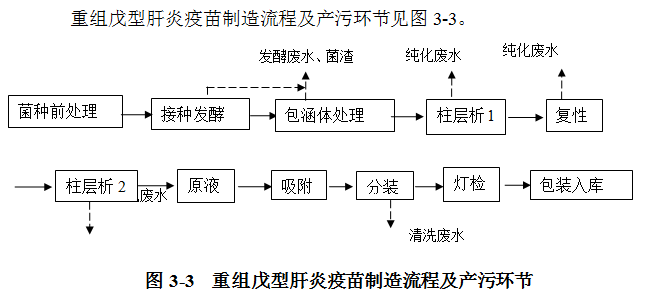
各制程说明如下:
①菌种前处理:将处于冷冻保存状态的工程菌复苏、划线培养(加入蛋白胨、酵母粉、氯化钠、葡萄糖等)分离单克隆、摇瓶培养到适合接种发酵罐。
②接种发酵:把摇瓶培养的工程菌在无菌条件下接种到发酵罐,然后通过控制发酵温度、pH值、溶氧量等措施,让菌体在发酵罐中生长到一定的浓度。这个过程是让工程菌通过发酵培养,产生我们所需要的蛋白质的过程。
③包涵体处理:由于我们需要的蛋白质存在于工程菌内,因此需要用物理的方法破碎细菌,使蛋白质释放出来,在经过离心的步骤,去除破碎后的细菌碎片。
①~③步骤属发酵阶段,由发酵车间完成,10万级区域操作,属带菌区。
本阶段主要污染源有离心、破碎排放发酵废水和菌体离心破碎产生的菌渣(危险固废),均带有菌种,主要污染物COD、BOD、氨氮。
④柱层析1:通过层析柱中的填料对目的蛋白非特异性吸附,用缓冲液(磷酸盐、尿素、氯化钠混合液)洗掉不能和填料结合的杂质后,再将结合到填料上的目的蛋白洗下来,达到提纯目的蛋白的目的。
⑤复性:为了提高疫苗的免疫原性,必须将线性的蛋白质装配成和病毒类似大小的颗粒,通过复性步骤可以达到这一目的。
⑥柱层析2:装配的蛋白质颗粒不可避免地会在尺寸上有所差异,通过这步柱层析可将不同大小的颗粒分离开来,然后收集我们需要的颗粒,这就是我们所需要的疫苗原液。
④~⑥三步骤属纯化阶段,由纯化车间完成,10级区操作,属无菌区。
本阶段属纯化过程,主要污染源有柱层析和复性过程排放纯化废水,废水主要污染物有杂蛋白、从柱层析排放出的磷酸盐、尿素、氯化钠等无机盐。
⑦吸附:将检验合格的原液按一定比例与氢氧化铝佐剂、氯化钠及硫柳汞配制,吸附到铝佐剂上,制成疫苗半成品。其目的一是可以提高疫苗的免疫原性,二是增强保存过程中疫苗的稳定性,保持活力。
⑧灌装:将半成品在无菌条件下,灌注到容器中,制成疫苗成品。
⑦~⑧步骤由制剂车间完成,在10万级~万区操作,属无菌区。
本阶段污染源主要为清洗器具、包装容器的清洗废水。氢氧化铝佐剂、氯化钠及硫柳汞直接进入产品,不排放。
⑨包装和入库:经过检验合格的疫苗成品需要经过贴标签、包装小盒、中盒等步骤后,放在冷库中保存。
本步骤由包装车间完成,在100级~1万级超净区完成。其中贴标签、包装小、中盒等工序在普通区完成。
本阶段主要污染物为包装废弃物。
(2)人乳头瘤病毒疫苗制造流程说明:
人乳头瘤病毒疫苗制造流程及产污环节见图3-4:
人乳头瘤病毒疫苗与戊型肝炎疫苗制造流程相同,所不同的是,人乳头瘤病毒疫苗制成了双价疫苗,可以形成针对两种亚型的乳头瘤状病毒感染的保护作用。在工艺上,这两种蛋白质(rHP16和rHP18)的原液分别与铝佐剂吸附后,再按照一定的比例混合,制成疫苗半成品。rHP16原液和rHP18原液生产与戊肝疫苗原液生产流程及产污环节基本相同, 在此不一一赘述。
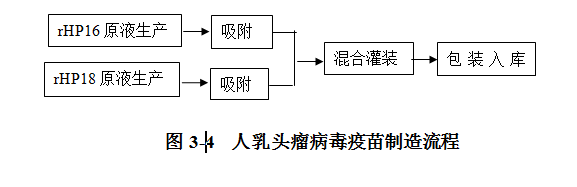
①rHP16生产工艺(原液部分)
菌种前处理→接种发酵→破碎粗提→柱层析1→复性→柱层析2→rHP16原液
②rHP18生产工艺(原液部分)
菌种前处理→接种发酵→破碎粗提→柱层析1→复性→柱层析2→rHP18原液
③半成品和成品生产
两种亚基分别吸附(用氢氧化铝佐剂吸附)并按比例混合→灌装→包装→入库。
(3)制水工艺流程:
生产过程所有用水均为纯水,厂区供水水源由城市管网引入厂区,经制水车间处理后以满足不同用水部门的要求。本项目制水量30t/a,图3-5为制水车间工艺流程图。
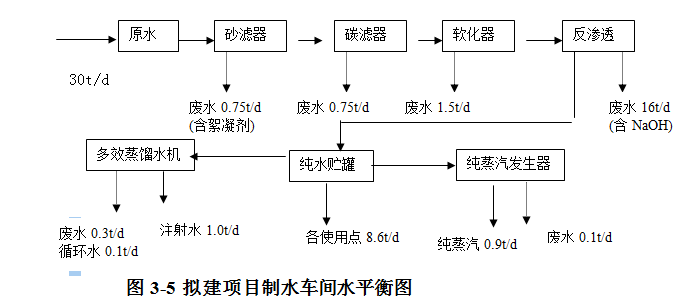
水平衡:本项目总用水量8940t/a,用水主要用于发酵、纯化、制剂车间清洗用水、动力车间锅炉用水、冷却塔补充新鲜水以及员工生活用水、绿化用水等。用水排水情况见表3-5。
表3-5 水平衡说明表
|
序号 |
用水单位 |
用水量(t/a) |
排水量(t/a) |
备注 |
|
1 |
发酵车间 |
155 |
141 |
14t/a进入产品 |
|
2 |
纯化车间 |
110 |
100 |
10t/a进入产品 |
|
3 |
灌装车间 |
6 |
0 |
全部进入产品 |
|
4 |
清洗用水 |
2000 |
1800 |
洗瓶、洗罐,排水系数0.9 |
|
5 |
动力车间(含制水车间) |
800 |
160 |
排水包括前处理水、锅炉污垢水 制水排污 |
|
6 |
生活用水 |
1750 |
1575 |
生活污水,排水系数0.9 |
|
7 |
冷却塔补新水 |
1000 |
0 |
|
|
8 |
绿化用水 |
3000 |
0 |
土壤吸收,不排放 |
|
9 |
研发中心 |
120 |
102 |
中试车间和生物实验室排水 |
|
10 |
合计 |
8940 |
3878 |
|
物料平衡:表3-6、3-7分别列出戊肝疫苗和人乳头瘤病毒疫苗物料平衡表。图3-6、3-7为戊肝疫苗和人乳头瘤病毒疫苗生产物料平衡图。
关于物料平衡说明:
磷酸盐:中试和产业化生产共使用磷酸盐1422.462 kg/a,主要用于菌种的发酵、纯化过程,从层析柱中直接回收427.7 kg/a,稀释后用于绿化施肥,只有极少量磷酸盐从废液中排出。
尿素:本项目戊肝疫苗生产年使用尿素815.6 kg/a,主要用于工艺过程中层析柱的处理,没有参与产品反应。每次生产后用EDTA螯合直接从层析柱回收统一保存起来,定期送有相应资质的危废处置部门处理,没有进入水体排放环境。人乳头瘤病毒疫苗生产线不使用尿素。
硫柳汞:本项目年使用硫柳汞0.31 kg/a,主要作为疫苗制剂消毒防腐剂用。在吸附阶段,检验合格的原液按一定比例与氢氧化铝佐剂、氯化钠及硫柳汞配制,吸附到铝佐剂上,制成疫苗半成品,全部进入产品不排放。
氢氧化铝盐:本项目年使用氢氧化铝24.68kg/a,作为铝佐剂,疫苗原液吸附在铝佐剂上,制成疫苗半成品,全部进入产品不排放。
DTT:分子生物试剂,即DL-Dithiothreitol,中文名为二硫苏糖醇。分子式为C4H10O2S2,分子量为154.25,纯度>99%。常用还原剂,有抗氧化作用。生产过程没有进入产品全部排放。
Tris(2,4-di-tert-butylphenyl):抗氧化剂168:Tris中文名为亚磷酸三(2,4 -二叔丁基苯基)酯,分子式:C42H63O3P分子量:646.9。生产过程没有进入产品全部排放。
表3-6戊肝疫苗物料平衡表
|
代号 |
名称 |
进入工艺量(kg/a) |
进入产品量 (kg/a) |
排放量 (kg/a) |
备注 |
|
A1 |
蛋白胨 |
4.781 |
9 |
1.781 |
|
|
A2 |
酵母粉 |
6 |
|
||
|
B1-B4 |
磷酸盐 |
24.29 |
8.21 |
16.08 |
其中7.7kg/a直接从层析柱上回收用于绿化 |
|
C |
氯化钠 |
24.04 |
9.12 |
14.92 |
|
|
D |
甘油 |
24L/a |
0 |
24L/a |
|
|
E |
铵盐 |
57.67 |
1.85 |
55.82 |
|
|
F |
氢氧化钠 |
10.77 |
4.07 |
6.7 |
|
|
G |
Tris |
0.76 |
0 |
0.76 |
|
|
H |
EDTA |
0.52 |
0 |
0.52 |
|
|
I |
尿素 |
815.6 |
0 |
815.6 |
|
|
J |
乙醇 |
38.5 |
0 |
38.5 |
|
|
L |
氢氧化铝 |
6.8 |
6.8 |
0 |
|
|
M |
柳硫汞 |
0.07 |
0.07 |
0 |
|
|
水 |
注射水+纯水 |
6.728 |
2.233 |
4.495 |
|
|
|
预充注射器 |
200.2万支 |
200万支 |
0.2 |
|
表3-7人乳头瘤病毒疫苗物料平衡表
|
代号 |
名称 |
进入工艺量 (kg/a) |
进入产品量 (kg/a) |
排放量 (kg/a) |
备注 |
|
A1 |
蛋白胨 |
184 |
56
|
300 |
|
|
A2 |
酵母粉 |
124 |
|
||
|
A3 |
酪蛋白 |
48 |
|
||
|
B1-B4 |
磷酸盐 |
1398.172 |
98.172 |
880 |
其中420kg/a直接从层析柱上回收用于绿化 |
|
C |
氯化钠 |
4237 |
1389 |
2848 |
|
|
D |
葡萄糖 |
192 |
102 |
13 |
其余40%在发酵时被氧化为CO2 |
|
E |
铵盐 |
12 |
0 |
12 |
|
|
F |
氢氧化钠 |
537.56 |
52.56 |
485 |
|
|
G |
Tris |
146 |
0 |
146 |
|
|
H |
EDTA |
90 |
0 |
90 |
|
|
I |
DTT |
113 |
0 |
113 |
|
|
J |
钙盐 |
10 |
0 |
10 |
|
|
K |
镁盐 |
13 |
0 |
13 |
|
|
L |
氢氧化铝 |
24 |
24 |
0 |
|
|
M |
柳硫汞 |
0.24 |
0.24 |
0 |
|
|
水 |
注射水+纯水 |
264.8 |
1.6 |
263.2 |
|
|
|
预充式注射器 |
800.8万支 |
800万支 |
0.8万支 |
|
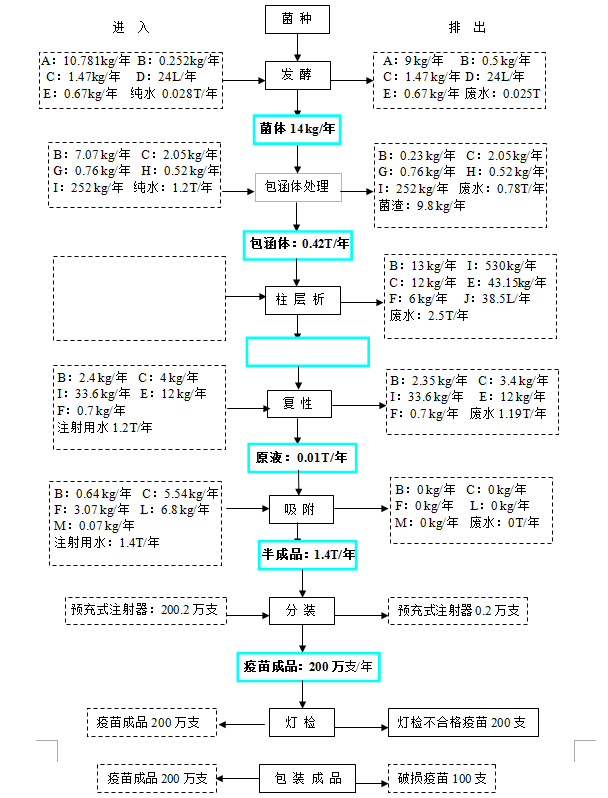
图3-6 戊肝疫苗生产物料平衡图

图3-7人乳头瘤病毒疫苗生产物料平衡图
①废水污染源分析
从工艺流程、物料平衡和水平衡分析可知:拟建项目戊肝疫苗和人乳头瘤病毒疫苗两条生产线生产工艺废水主要有发酵车间排放的发酵废水、纯化车间排放的废水、制剂车间清洗器具、包装容器清洗废水以及质检废水。根据类比调查:上述废水主要污染物为PH、COD、BOD、总磷、氨氮。
发酵废水:发酵车间发酵、包涵体处理(包括离心、破碎)工序产生的发酵废水,其中戊肝疫苗生产线发酵废水产生量0.805 t/a,人乳头瘤病毒疫苗生产线发酵废水产生量140t/a,合计发酵废水产生量约141 t/a,废水主要污染物有磷酸盐、氯化钠等无机盐。根据类比调查,废水COD约为30000mg/l,带菌种。发酵废水在车间内经高温蒸汽灭菌消毒、0.2um膜过滤后,滤渣拟按危险固废处置,滤液再次高温灭菌消毒后进入废水处理系统处理。
纯化废水:纯化车间柱层析、复性过程产生的纯化废水,其中戊肝疫苗生产线纯化废水产生量3.69 t/a,人乳头瘤病毒疫苗生产线发酵废水产生量96.41t/a,合计纯化废水产生量100 t/a,废水主要污染物有杂蛋白、从柱层析排放出的磷酸盐、尿素、氯化钠等无机盐,废酸废碱,由于氢氧化铝、硫柳汞全部进入产品,没有排放,因此,废水中不含有铝离子和汞离子。根据类比调查,纯化废水COD约为1400 mg/l。
制剂车间清洗废水:主要为清洗制剂灌装各种器具、包装容器产生的清洗废水,废水产生量1800t/a,废水主要污染物COD、SS、BOD。
质检废水:研发中心中试车间和产业化生产线原液检定、半成品配制、半成品检定和成品检定各步骤产生的质检废水,这部分废水产生量较少,其中原液检定废水带有菌种,需进行高温灭菌消毒处理,废水主要污染物COD、BOD、氨氮。
动力车间废水:主要为锅炉污垢水和锅炉水前处理排放污水,产生量160t/a,主要污染物为钙、镁、PH。同样,制水车间也会产生少量排污水,由于排放量少,不在分析。
生活污水:生活废水排放量1575t/a,主要污染物COD:350mg/L、BOD5:200mg/L;NH3-N:20mg/L。
研发中心生物实验室及中试车间主要是进行两种疫苗制造工艺与质量标准开发试验,即确定生产工艺,放大生产规模,中试车间发酵、纯化、制剂车间同样也会产生相应的发酵废水、纯化废水和制剂废水,根据类比调查,研发中心生物实验室及中试车间各部门废水产生量约占产生化生产线排水量5%,即中试车间发酵废水产生量约7t/a,纯化废水5t/a、制剂车间清洗废水90t/a。
拟建项目废水污染源及其源强列表3-8。
②废水污染控制措施
a.发酵车间产生的发酵废水在车间内高温高压蒸汽灭菌消毒、0.2um膜过滤后,滤渣拟按危险固废处置,滤液再次高温灭菌消毒后进入废水处理系统处理。
b.纯化废水、制剂废水集中进入厂内污水处理系统,污水拟采用SBR生化处理+深度处理措施处理至《城市污水再生利用城市杂用水水质》(GB/T18920-2002)中的标准限值后用于厂区绿地灌溉。
c.质检废水按上述原则系统处理(即原液检定废水进行高温灭菌,其它质检废水进行无害化处理后排入厂内污水处理系统)。
d.生活污水经厂区配套的化粪池处理至DB 35/322-1999《厦门市水污染物排放控制标准》的表4三级标准后排入园区市政污水管网。
e.锅炉蒸汽系统冷凝和设备冷却水包括冻干机、发酵罐、蒸馏水机、热交换器以及少量制水车间排污水等不再回收使用,经沉淀、中和处理后直接排入园区污水管网。
![]() f.按GMP要求,百万级车间不设地漏,其他排水地漏采用不锈钢卫生型结构,地漏口有水封装置,定期喷洒消毒液,每个地漏排水口下面设有S型存水弯管,防止厂外空气进入车间。
f.按GMP要求,百万级车间不设地漏,其他排水地漏采用不锈钢卫生型结构,地漏口有水封装置,定期喷洒消毒液,每个地漏排水口下面设有S型存水弯管,防止厂外空气进入车间。
g.研发中心生物实验室和中试车间各区排放的废水按上述原则处理后再排入污水处理系统处理。
h.动力车间锅炉排污水、前处理废水以及制水车间排污水主要污染物为钙、镁离子、碱性强,经中和、沉淀过滤处理后部分回用于绿地灌溉和道路冲洗等,多余直接排入园区市政污水管网。
表3-8 拟建项目废水污染源及其源强预测分析
|
序 号 |
污染源 |
污染源强 |
COD污染负荷率% |
||||
|
废水量 (t/a) |
COD |
BOD |
|||||
|
排放浓度(mg/L) |
排放量 (t/a) |
排放浓度(mg/l) |
排放量 (t/a) |
||||
|
1 |
发酵车间 |
148 |
30000 |
4.44 |
9960.0 |
1.47 |
83.1 |
|
2 |
纯化车间 |
105 |
1400 |
0.15 |
430.0 |
0.045 |
2.81 |
|
3 |
制剂车间 |
1890 |
100 |
0.19 |
25 |
0.05 |
3.56 |
|
4 |
锅炉车间 |
160 |
60 |
0.0096 |
- |
- |
- |
|
5 |
生活污水 |
1575 |
350 |
0.55 |
250 |
0.39 |
9.91 |
|
合计 |
|
3878 |
|
5.34 |
|
1.96 |
|
工业废水处理设施的设计选型要求
1)应选择经济可靠、占地少、投资省的工艺;
2)操作管理方便,自动化程度较高,便于维护;
3)项目设计选择最佳处理工艺,做到工艺运行可靠,流程简单;
4)符合相关环保法规的排放要求;
上一篇: 浅析污水处理设备的防护工艺与设备
下一篇: 浅谈水利工程的环保设计
*注:以上内容均来自网络转载,如有版权问题,请及时联系我们!